Infos
Ozone
L’ozone est un gaz qui est présent dans l’atmosphère. Une molécule d’ozone est composée de 3 atomes d’oxygène (formule chimique O3), contrairement à la molécule d’oxygène ordinaire qui est composée de deux atomes (O2). L’ozone a une odeur caractéristique que l’on retrouve aussi dans les décharges électriques (par exemple les vieux photocopieurs).
Comment l’ozone se forme-t-il dans l’atmosphère ?
L’ozone se forme lorsque l’énergie du rayonnement ultraviolet (rayons UV) devient suffisamment importante pour briser les molécules d’oxygène (O2) en atomes d’oxygène séparés (O). Les atomes d’oxygène libres peuvent se recombiner et former des molécules d’oxygène ordinaires (O2). Lorsqu’un atome libre (O) rencontre une molécule d’oxygène (O2), il peut alors se former une nouvelle molécule qui contient trois atomes d’oxygène. Il s’agit alors d’une molécule d’ozone (O3).
Les molécules d’ozone peuvent à leur tour être séparées suite au rayonnement UV, de sorte que se forment à nouveau une molécule d’oxygène (O2) et un atome d’oxygène libre (O). L’ozone est donc constamment formé et décomposé par le rayonnement UV du soleil. Ce processus de formation et dégradation de l’ozone se produit dans un certain équilibre (comme beaucoup de processus similaires) de sorte qu’il existe toujours une quantité d’ozone relativement constante dans l’atmosphère. La concentration est très faible : pour 10 millions de molécules dans l’air, seuls 3 sont des molécules d’ozone. La quantité d’ozone peut toutefois varier considérablement dans le temps et l’espace, ce qui est influencé par la présence d’autres composants chimiques impliqués dans ces réactions chimiques et des mouvements de l’atmosphère. Plus d’informations peuvent se trouver dans notre rubrique « couche d’ozone » (en anglais).
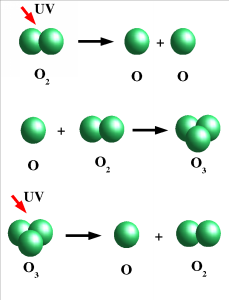
Représentation schématique de la formation et décomposition photochimiques de l’ozone dans l’
L’ozone est-il positif ou négatif ?
Le rayonnement de plus haute énergie du soleil est souvent appelé uvc (leur longueur d’onde est plus courte que 280 nm) et ils sont très nocifs à la vie sur terre (ils sont dommageables pour l’ADN). Ils sont toutefois heureusement absorbés par les molécules d’oxygène et d’ozone. Les uvb (longueur d’onde 280-315 nm) sont aussi dangereux (par exemple pour les coups de soleil, le cancer de la peau, la cataracte) mais ils sont également partiellement absorbés par l’ozone dans l’atmosphère.
L’ozone dans l’atmosphère est donc essentiel pour la protection contre les rayons uvb, toutefois l’ozone est aussi irritant pour le système respiratoire. C’est pourquoi on distingue le « bon » ozone qui se trouve haut dans l’atmosphère (dans la stratosphère) et nous protège contre les rayons uv, et le « mauvais » ozone au sol (dans la troposphère) qui est nocif. La distribution verticale de l’ozone est décrite dans la rubrique « couche d’ozone » (en anglais).
